Benih ikan merupakan komponen terpenting dalam budidaya ikan. Sumber daya air tawar negara kita untuk budidaya ikan diperkirakan 2,85 juta hektar kolam dan tangki. Selain itu, 2,05 juta hektar lagi tersedia perairan dalam bentuk waduk atau danau. Diperkirakan bahwa hampir 14250 juta benih akan dibutuhkan untuk penebaran bahkan saat ini tersedia 2,85 juta hektar dengan tingkat penebaran konservatif 5.000 benih/ha. Produksi saat ini 1.5007 juta ekor. Selain ini, sedikitnya dibutuhkan tambahan 4100 juta ekor benih untuk menebar di areal danau dan waduk yang tersedia dengan rata-rata tingkat penebaran 2000 ekor/ha. Hal ini menunjukkan perlunya pemeliharaan benih untuk persediaan sumber air yang tersedia.
Benih ikan diperoleh dari tiga sumber – sungai, tempat penetasan dan bundh. Pengumpulan benih dari sumber sungai adalah praktik kuno. Metode ini berat dan kami mendapatkan campuran benih ikan yang diinginkan dan tidak diinginkan. Penetasan adalah cara terbaik untuk mendapatkan benih ikan. Selain ini, penangkaran bundh juga merupakan metode yang baik untuk mengumpulkan benih ikan dengan menciptakan habitat alami.
Sistem sungai yang berbeda di India menunjukkan variasi yang berkaitan dengan distribusi dan kelimpahan fauna ikan mereka. Hal ini terutama disebabkan oleh kondisi ekologi masing-masing, seperti gradien, medan, mengalir, kedalaman, suhu, substrat, dll. Sungai utara adalah abadi dan mendukung perikanan komersial yang kaya. Kecuali daerah delta, perikanan di sungai-sungai semenanjung itu buruk baik di hulu maupun di tengah.
1 Saya n du C e D B R ed Saya n G T e C H tidak aku Hai G kamu
Ikan mas berkembang biak di perairan yang mengalir seperti sungai. Secara alami mereka tidak pernah berkembang biak di perairan terbatas. Benih yang dikumpulkan dari sumber daya alam umumnya merupakan stok campuran dengan varietas yang diinginkan dan yang tidak diinginkan. Pemisahan benih yang diinginkan dari stok campuran adalah masalah besar. Karena penanganannya, varietas yang diinginkan bisa mati. Jika ditemukan benih ikan predator, mereka melukai benih ikan yang diinginkan. Masalah besar lainnya adalah tidak pernah mendapatkan jumlah yang dibutuhkan dalam koleksi alam. Ketersediaan benih murni sangat sulit. Untuk mengatasi semua masalah tersebut induced breeding merupakan teknik yang sangat baik untuk mendapatkan benih ikan yang murni dan dibutuhkan. Ini memiliki beberapa keuntungan. Dengan pemuliaan yang diinduksi benih murni dari spesies yang diinginkan dapat diperoleh. Misalkan benih rohu diperlukan, hanya benih rohu yang dapat diproduksi dalam beberapa hari. Jumlah benih yang dibutuhkan dapat diproduksi dengan teknik ini. Misalkan sebuah peternakan ikan membutuhkan 1 crore benih ikan, nomor ini dapat diproduksi dengan sangat mudah dalam waktu yang lebih singkat. Masalah identifikasi dan pemisahan benih tidak muncul. Teknik ini sangat sederhana. Benih yang sehat dapat dihasilkan. Ikan dapat bertelur lebih dari satu kali dalam satu tahun. Hibridisasi dimungkinkan.
Dalam teknik pemuliaan terinduksi, empat jenis bahan utama yang digunakan untuk memberikan suntikan pada ikan – ekstraksi kelenjar pituitari, HCG, ovaprim dan ovatida.
India kamu ce D Breedin G akal H Pi T uitar kamu kelenjar D Ekstra A ctio n
Pemuliaan ikan dengan ekstraksi kelenjar pituitari adalah cara yang efektif dan dapat diandalkan untuk mendapatkan benih murni dari ikan yang dapat dibudidayakan dan dipraktekkan saat ini dalam skala yang cukup luas di India serta banyak negara lain di dunia. Ini melibatkan penyuntikan ikan betina dan jantan dewasa dengan ekstrak kelenjar pituitari yang diambil dari ikan dewasa lainnya.
H sejarah C A aku Kembali G bulat:
Konsep peran hipofisis saat ini dalam reproduksi vertebrata dilaporkan berasal dari eksperimen Aschheim dan Zondek pada tahun 1927 ketika mereka menemukan bahwa implan hipofisis mempercepat perkembangan seksual tikus betina. Tiga tahun kemudian, pada tahun 1930, Houssay dari Argentina melakukan percobaan pertama pada seekor ikan. Dia menyuntikkan ikan lele vivipar kecil, Cresterodon decammaculatus dengan ekstrak kelenjar pituitari dibuat dari ikan lain, Prochilodus platensis menyebabkan kelahiran prematur dari anak yang sedang berkembang. Pada tahun 1934, sebuah teknik yang berhasil dapat dilakukan oleh Von Ihring pada beberapa ikan kolam Brasil yang dibuat untuk bertelur dengan menyuntikkan mereka dengan suspensi kelenjar pituitari segar yang dikumpulkan dari spesies ikan lain yang kurang berharga. Orang Brasil, dengan demikian, adalah orang pertama yang berhasil menggunakan teknik pemuliaan ikan melalui hipofisis. Pada tahun 1937, Ilmuwan Rusia Gerbiskii berhasil menginduksi sejumlah besar ikan sturgeon, Acipenser stellatus.
India adalah negara ketiga di dunia yang menjadikan teknik ini sebagai bagian integral dari program piscicultural-nya. Upaya hipofisis pertama di India dilakukan oleh Hamid Khan pada tahun 1937 ketika ia mencoba menginduksi pemijahan di Cirrhinus mrigala dengan menyuntikkan kelenjar hipofisis mamalia. Percobaan selanjutnya dilakukan oleh Hussain pada tahun 1945 dengan hormon tertentu seperti 80-120 RV Prolan dan Antuitrin-S menjadi Labeo rohita betina dan Cirrhinus mrigala. Pada tahun 1955, Hiralal Choudhuri berhasil menginduksi pemijahan di Esomus danricus dengan injeksi intraperitonal ekstrak pituitari Catla catla. Ia juga berhasil membiakkan Pseudotropius atherinoides. Ramaswamy dan Sunderraj berhasil berkembang biak di Heteropneustes fossilis dan Clarias batrachus masing-masing pada tahun 1955 dan 1956. Keberhasilan pertama dalam pemuliaan ikan mas India yang diinduksi melalui hipofisis dicapai pada tahun 1957 oleh Hiralal Chaudhuri dan Alikunhi di CIFRI, serangan balik.
fis H P Saya tuit A R kamu Gla n D :
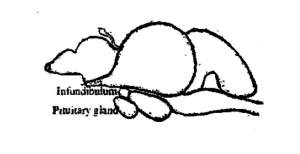
Kelenjar hipofisis ikan berukuran kecil, tubuh lunak dan berwarna putih krem. Ini kurang lebih bulat pada ikan mas. Itu terletak di sisi ventral otak (Gbr. 3.1) di belakang chiasma optik di cekungan dasar kotak otak, dikenal sebagai Sella tursika dan diselubungi oleh selaput tipis yang disebut duramater. Pada beberapa ikan itu melekat pada otak dengan tangkai tipis, dikenal sebagai tangkai infundibular. Berdasarkan tangkai infundibular, kelenjar diklasifikasikan menjadi dua jenis, yaitu, platybasic – tanpa tangkai, memiliki reses infundibular terbuka dan leptobasic – dengan tangkai, telah melenyapkan reses infundibular. Kelenjar hipofisis tipe leptobasic terdapat pada ikan mas dan tipe platybasic terdapat pada channidae dan nandidae. Ukuran dan berat kelenjar bervariasi sesuai dengan ukuran dan berat ikan. Di Labeo rohita, berat rata-rata kelenjar pituitari adalah 6,6 mg dalam 1-2 kg ikan, 10,3 mg dalam 2-3 kg ikan, 15,2 mg dalam 3-4 kg ikan dan 18,6 mg dalam 4-5 kg ikan.
Kelenjar hipofisis mensekresikan hormon gonadotropik, FSH atau Follicular Stimulating Hormone, dan LH atau Luteinizing Hormone. Kedua hormon disekresikan sepanjang tahun, tetapi proporsi di mana mereka disekresikan secara langsung berkorelasi dengan siklus kematangan gonad. FSH menyebabkan pertumbuhan dan pematangan folikel ovarium pada wanita dan spermatogenesis pada testis pria. LH membantu dalam mengubah folikel ovarium menjadi korpus lutea pada wanita dan mempromosikan produksi testosteron pada pria. Hormon-hormon ini tidak spesifik spesies, yaitu., hormon yang diperoleh dari satu spesies mampu merangsang gonad ikan lain. Namun, ada variabilitas besar dalam efektivitasnya pada spesies yang berbeda. Eksperimen yang dilakukan pada pemuliaan ikan yang diinduksi telah dengan jelas menunjukkan efektivitas relatif ekstrak hipofisis ikan dibandingkan hormon hipofisis mamalia, hormon seks dan berbagai steroid. Inilah alasan mengapa hipofisis ikan banyak digunakan saat ini dalam pekerjaan pemuliaan ikan di seluruh dunia.
Koleksi Hai n Hai F pituitar kamu Kelenjar :
Ikan menyumbangkan kelenjar pituitari yaitu, ikan dari mana kelenjar pituitari dikumpulkan disebut ikan donor. Keberhasilan dalam pemuliaan ikan yang diinduksi sangat bergantung pada pemilihan ikan donor yang tepat. Kelenjar sebaiknya dikumpulkan dari ikan gravid matang, sebagai kelenjar paling ampuh pada saat berkembang biak atau sesaat sebelum pemijahan. Potensi kelenjar menurun setelah pemijahan. Kelenjar yang dikumpulkan dari ikan yang belum dewasa atau ikan bekas biasanya tidak memberikan hasil yang memuaskan. Kelenjar pada ikan hasil kawin yang dikumpulkan segera setelah pemijahan juga terbukti efektif dan dapat digunakan untuk pemuliaan ikan lain. Waktu yang paling cocok di India untuk pengumpulan kelenjar pituitari ikan mas utama adalah selama bulan Mei hingga Juli, karena sebagian besar ikan mas mencapai tahap lanjut kematangan mereka selama periode ini. Sejak ikan mas biasa, Cyprinus carpio adalah pemulia abadi, individu dewasanya dapat diperoleh hampir sepanjang tahun untuk pengumpulan kelenjar. Kelenjar biasanya lebih disukai untuk dikumpulkan dari ikan yang baru dibunuh tetapi yang dikumpulkan dari spesimen yang diawetkan es juga digunakan.
Beberapa teknik diadopsi untuk pengumpulan kelenjar pituitari di berbagai negara. Di India, teknik pengumpulan kelenjar yang umum diadopsi adalah dengan memotong kulit kepala tengkorak ikan dengan pukulan miring dari pisau daging. Setelah kulit kepala diangkat, materi abu-abu dan zat lemak yang terletak di atas otak dibersihkan dengan lembut dengan sepotong kapas. Otak yang terbuka dengan demikian diangkat dengan hati-hati dengan melepaskannya dari saraf. Pada sebagian besar cyprinids, ketika otak diangkat, kelenjar tertinggal di lantai kotak otak. Durameter yang menutupi kelenjar kemudian diangkat dengan hati-hati menggunakan jarum halus dan forsep. Kelenjar yang terbuka kemudian diangkat secara utuh tanpa menyebabkan kerusakan apapun karena kelenjar yang rusak dan pecah mengakibatkan hilangnya potensi.
Kelenjar juga dikumpulkan melalui foramen magnum. Dia, nyatanya, metode pengangkatan kelenjar yang jauh lebih mudah yang biasa dilakukan oleh para profesional untuk pengumpulan skala massal di pasar ikan yang ramai dan bising. Dalam metode pengumpulan kelenjar ini, ikan harus dipenggal kepalanya. Di pasar, kelenjar dikumpulkan dari kepala ikan yang sudah dipotong oleh pengecer. Di kepala ikan yang dipotong, foramen dapat terlihat jelas dari belakang memegang materi abu-abu dan zat lemak di dalamnya. Otak terletak di sisi ventral foramen. Untuk mengeluarkan kelenjar, materi abu-abu dan substansi lemak pertama-tama dikeluarkan dengan memasukkan ujung tang yang tumpul ke dalam foramen dan menarik keluar seluruh materi tanpa mengganggu otak. Otak diangkat dengan hati-hati dan didorong ke depan atau ditarik keluar dari lubang. Kelenjar yang terletak di lantai kotak otak kemudian diambil menggunakan pinset halus. Seorang pekerja eksperimental dengan mudah berhasil mengumpulkan sekitar 50-60 kelenjar dalam satu jam dengan mengadopsi teknik pengumpulan ini.
P reservasi Hai F Pituit A R kamu Kelenjar S :
Jika kelenjar yang dikumpulkan tidak dimaksudkan untuk digunakan saat itu juga, mereka harus dilestarikan. Karena sifat gliko atau mukoproteinnya, mereka bertanggung jawab untuk tindakan enzimatik segera. Kelenjar pituitari dapat diawetkan dengan tiga metode – alkohol absolut, aseton dan pembekuan. Pengawetan kelenjar pituitari ikan dalam alkohol absolut lebih disukai di India. Lebih-lebih lagi, percobaan yang dilakukan sejauh ini dengan kelenjar yang diawetkan alkohol pada ikan mas besar India telah memberikan hasil yang lebih positif dibandingkan dengan kelenjar diawetkan aseton.
Kelenjar setelah pengumpulan segera dimasukkan ke dalam alkohol absolut untuk menghilangkan lemak dan dehidrasi. Setiap kelenjar disimpan dalam botol terpisah yang ditandai secara berurutan untuk memudahkan identifikasi. Setelah 24 jam, kelenjar dicuci dengan alkohol absolut dan disimpan lagi dalam alkohol absolut segar yang terkandung dalam botol warna gelap dan disimpan baik pada suhu kamar atau di lemari es. Mengubah alkohol sesekali membantu menjaga kelenjar dalam kondisi baik untuk waktu yang lebih lama. Untuk mencegah kelembaban masuk ke dalam botol, mereka dapat disimpan di dalam desikator yang mengandung beberapa kalsium klorida anhidrat. Lebih baik menyimpan kelenjar di lemari es. Mereka dapat disimpan di lemari es hingga 2-3 tahun dan pada suhu kamar hingga satu tahun.
Aseton juga merupakan pengawet yang baik. Dalam metode ini, segera setelah pengumpulan, kelenjar disimpan dalam aseton segar atau dalam aseton dingin es kering di dalam lemari es pada 100 C selama 36-48 jam. Selama periode ini, aseton diganti 2-3 kali pada interval sekitar 8-12 jam untuk penghilangan lemak dan dehidrasi yang tepat. Kelenjar kemudian diambil dari aseton, diletakkan di atas kertas saring dan dibiarkan kering pada suhu kamar selama satu jam. Kemudian disimpan dalam lemari es pada suhu 100 C, lebih disukai dalam desikator yang diisi dengan kalsium klorida atau bahan pengering lainnya. Pelestarian kelenjar dalam aseton sebagian besar dilakukan di Uni Soviet dan AS.
P ganti rugi Hai F Pituita R kamu Gl A n D E ekstrak :
Kelenjar yang diawetkan kemudian ditimbang. Hal ini penting untuk penentuan dosis yang tepat yang akan diberikan sesuai dengan bobot indukan. Berat kelenjar dapat diambil secara individu atau dalam kelompok. Untuk mendapatkan bobot yang lebih akurat, kelenjar harus ditimbang tepat setelah dua menit dikeluarkan dari alkohol.
Ekstrak hipofisis harus disiapkan sebelum waktu injeksi. Jumlah kelenjar yang dibutuhkan untuk injeksi pertama-tama dihitung dari berat breeder yang akan disuntik. Kelenjar kemudian dipilih dan jumlah kelenjar yang dibutuhkan dikeluarkan dari botol. Alkohol dibiarkan menguap, jika kelenjar adalah yang diawetkan alkohol. Kelenjar aseton-kering langsung diambil dari botol untuk maserasi.
Kelenjar tersebut kemudian dimaserasi dalam homogeniser jaringan dengan menambahkan sejumlah air suling atau larutan garam biasa atau larutan fisiologis lainnya yang isotonik dengan darah ikan penerima. Hasil paling sukses dari pembiakan induksi pada ikan mas India sejauh ini telah diperoleh dengan air suling dan larutan garam biasa 0,3%. Konsentrasi ekstrak biasanya disimpan dalam kisaran 1-4 mg kelenjar per 0,1 ml media yaitu, pada tingkat 20-30 gram. kelenjar dalam 1,0 ml media. Setelah homogen, suspensi dipindahkan ke dalam tabung sentrifus. Saat mentransfer, homogenat harus dikocok dengan baik sehingga partikel kelenjar yang mengendap yang dicampur dengan larutan masuk ke dalam tabung sentrifus. Ekstrak dalam tabung disentrifugasi dan cairan supernaten ditarik ke dalam jarum suntik hipodermik untuk injeksi.
Ekstrak hipofisis juga dapat disiapkan dalam jumlah besar dan diawetkan dalam gliserin (1 bagian ekstrak :2 bagian gliserin) sebelum musim pengembangbiakan ikan sehingga tidak perlu repot menyiapkan ekstrak setiap kali sebelum penyuntikan. Ekstrak stok harus selalu disimpan di lemari es atau di dalam es.
T e C H niq kamu e Hai F B ree D ing :
Operasi pemuliaan ikan mas besar yang diinduksi dilakukan ketika musim hujan yang teratur masuk, ikan menjadi matang sepenuhnya dan suhu air turun. Betina memiliki putaran, perut yang lembut dan menonjol dengan lubang kemerahan yang bengkak dan pejantan dengan cairan yang keluar bebas dipilih untuk dikembangbiakkan. Peternak jantan juga dapat dengan mudah dibedakan dengan kekasaran pada permukaan punggung sirip dada.
1 . Mengerjakan S ag e Hai F pitui T ar kamu tambahan A C T :
Aspek terpenting dari pemuliaan ikan yang diinduksi adalah penilaian dosis ekstrak hipofisis yang tepat. Potensi kelenjar bervariasi sesuai dengan ukuran dan tahap perkembangan seksual donor, serta spesies ikan donor, waktu pengumpulan kelenjar dan pengawetannya yang tepat. Dosis kelenjar pituitari dihitung dalam kaitannya dengan berat indukan yang akan disuntik. Juga telah diketahui bahwa dosis yang identik untuk breeder dengan bobot yang sama dapat memberikan hasil yang kontradiktif karena perbedaan kematangan gonad. Bahkan hormon dosis tinggi mungkin tidak efektif jika gonad berada dalam tahap resorpsi. Dengan pemilihan breeder yang cermat dan pemberian ekstrak kelenjar pituitari yang diketahui beratnya per kg berat badan breeder, pemuliaan yang berhasil dapat diperoleh.
Percobaan pada standarisasi dosis menunjukkan bahwa pemberian dosis rendah awal pada induk betina diikuti dengan dosis efektif yang lebih tinggi setelah 6 jam terbukti lebih berhasil daripada dosis knockout tunggal. Dosis tinggi tunggal telah ditemukan berguna ketika peternak berada dalam kondisi ideal dan cuaca mendukung. Rohu merespon dengan baik untuk dua suntikan sementara catla dan mrigal untuk satu dan dua suntikan.
Dosis awal pada tingkat 2-3 mg. kelenjar pituitari per kg berat badan ikan diberikan kepada indukan betina saja. Peternak jantan tidak memerlukan dosis awal, jika mereka mengeluarkan cairan dengan sedikit tekanan pada perut mereka. Dua pejantan melawan setiap betina membuat satu set pemuliaan. Untuk membuat set pencocokan yang baik, berat jantan bersama-sama harus sama dengan atau lebih dari betina. Dalam hal kondisi salah satu dari dua pejantan tidak ditemukan pada tahap bebas mengalir, suntikan awal dapat diberikan kepada laki-laki dengan kecepatan 2-3 mg/kg berat badan. Setelah 6 jam, dosis kedua 5-8 mg/kg berat badan diberikan kepada betina, sedangkan kedua laki-laki menerima dosis pertama atau kedua pada tingkat 2-3 mg/kg berat badan. Sedikit perubahan dalam dosis dapat dilakukan tergantung pada kondisi kematangan breeder dan faktor lingkungan yang ada. Dengan tidak adanya keseimbangan kimia, 1-3 kelenjar pituitari efektif untuk sepasang ikan.
2 . M e meskipun D Hai F injeksi :
Suntikan intra-kranial lebih disukai di USSR dan intra-peritoneal di Amerika Serikat dan Jepang. Injeksi intra-otot adalah praktik yang paling umum di India. Suntikan intra-otot kurang berisiko dibandingkan dengan metode lainnya. Suntikan intra-peritonial biasanya diberikan melalui daerah lunak tubuh, umumnya di dasar sirip perut atau kadang-kadang di dasar sirip dada. Tapi ada beberapa risiko merusak organ dalam, khususnya gonad yang buncit saat memberikan injeksi intra-peritonial pada ikan dewasa.
Suntikan biasanya diberikan di pangkal ekor atau daerah bahu dekat pangkal sirip punggung. Sambil memberikan suntikan pada ikan mas, jarum dimasukkan di bawah timbangan dengan menjaganya sejajar dengan tubuh ikan pada awalnya dan kemudian menusuk otot secara miring. Tidak ada aturan keras dan cepat mengenai waktu injeksi. Suntikan dapat diberikan kapan saja, siang dan malam. Tetapi karena suhu rendah sangat membantu dan waktu malam relatif lebih tenang, suntikan umumnya diberikan pada sore atau malam hari dengan pengaturan waktu
Benih Produksi T teknologi 33
disesuaikan sehingga ikan dapat menggunakan ketenangan malam untuk pemijahan yang tidak terganggu.
Jarum suntik hipodermik yang paling nyaman digunakan untuk tujuan tersebut adalah jarum suntik 2 cc yang memiliki tingkat pembagian 0,1 cc. Besar kecilnya jarum suntik tergantung dari ukuran indukan yang akan disuntik. Jarum no 22 nyaman digunakan untuk ikan gurame 1-3 kg, Nomor 19 untuk ikan mas yang lebih besar dan Nomor 24 dapat digunakan untuk ikan mas yang lebih kecil.
Penggunaan obat bius selama penyuntikan akan meningkatkan kelangsungan hidup induk ikan secara signifikan. Anestesi yang umum digunakan adalah MS 222 dan Quinaldine. MS 222 dapat ditambahkan ke dalam air dalam dosis 50-100 mg/liter. Gulungan kapas yang direndam dalam larutan 0,04 M dapat dimasukkan ke dalam mulut ikan. Quinaldine digunakan pada tingkat 50-100 mg / liter.
3 . B reedin G H ap A NS D spa w ning :
Setelah injeksi, indukan dilepaskan segera di dalam hapa pembiakan. Sebuah hapa pembibitan umumnya terbuat dari kain halus berukuran 3,5 x 1,5 x 1,0 m untuk indukan yang lebih besar dan 2,5 x 1,2 x 1,0 m untuk indukan dengan berat kurang dari 3 kg. Semua sisi hapa pembiakan dijahit dan ditutup kecuali sebagian di bagian atas untuk memasukkan indukan ke dalam. Umumnya, satu set breeder dilepaskan di dalam setiap hapa breeding, tapi terkadang, untuk menghemat bahan hipofisis, Pemuliaan komunitas juga dicoba dengan mengurangi jumlah peternak jantan. Setelah pelepasan ikan, bukaan hapa ditutup rapat agar indukan tidak melompat keluar dan kabur. Alih-alih hapas, tangki semen atau kolam plastik sebesar hapas juga bisa digunakan untuk pembibitan.
Pemijahan biasanya terjadi dalam waktu 3-6 jam setelah penyuntikan kedua. Segera setelah pembuahan, telur membengkak jauh karena penyerapan air. Telur ikan mas besar yang dibuahi tampak seperti manik-manik kaca yang bersinar dengan transparansi sebening kristal, sedangkan telur yang tidak dibuahi terlihat buram dan keputihan. Ukuran telur dari spesies yang sama dari peternak yang berbeda sangat bervariasi. Telur ikan mas India yang membengkak penuh berukuran diameter 2,5 mm, yang terbesar adalah catla dan yang terkecil dari rohu. Telur ikan mas adalah jenis non-mengambang dan non-perekat. Kuning telur tidak memiliki globul minyak. Ikan mas besar India memiliki kapasitas bertelur yang banyak. Kesuburan mereka, rata-rata, adalah 3,1 lakh di rohu, 1-3 lakh di catla dan 1,5 lakh di mrigal.
Telur-telur yang sedang berkembang dipertahankan dalam pembiakan hapa tidak terganggu untuk jangka waktu setidaknya 4-5 jam setelah pemijahan untuk memungkinkan telur-telur itu mengeras dengan air dengan benar. Setelah ini, telur dikumpulkan dari hapa menggunakan cangkir dan dipindahkan ke ember dengan sedikit air. Indukan tersebut kemudian dibawa keluar dan ditimbang untuk mengetahui perbedaan sebelum dan sesudah pemijahan. Ini memberikan gambaran tentang jumlah telur yang diletakkan. Volume total dan jumlah telur dapat dengan mudah dihitung dari volume yang diketahui dan jumlah telur dari cangkir sampel. Persentase telur yang dibuahi juga dinilai dengan melakukan sampling acak sebelum dan sesudah pemijahan. Ini memberikan gambaran tentang jumlah telur yang diletakkan. Volume total dan jumlah telur dapat dengan mudah dihitung dari volume yang diketahui dan jumlah telur dari cangkir sampel. Persentase telur yang dibuahi juga dinilai dengan melakukan random sampling.
4 . S tiga P pin G :
Namun ikan mas Cina tidak bertelur secara alami dan ketika mereka bertelur, persentase pembuahan umumnya sangat rendah. Oleh karena itu, pengupasan (Gbr. 3.1) atau inseminasi buatan diikuti. Ikan betina dipegang dengan kepala miring ke atas dan ekor ke bawah dan perut menghadap ke kapal, dan telur dikumpulkan ke dalam enamel atau palung plastik dengan menekan tubuh betina. Ikan jantan kemudian dipegang dengan cara yang sama dan susu diperas ke dalam bak yang sama. Gamet-gamet tersebut kemudian dicampur sesegera mungkin dengan menggunakan bulu ayam untuk memungkinkan pembuahan. Telur yang telah dibuahi kemudian dicuci beberapa kali dengan air bersih untuk menghilangkan kelebihan kotoran dan dibiarkan tidak terganggu di air tawar selama sekitar 30 menit. Telur-telur tersebut kemudian siap untuk dilepaskan ke dalam tangki penetasan.

T e chn Saya qu e Hai F H A tch Saya n G T H e e ggs :
Telur yang dikumpulkan dari pemuliaan hapas dipindahkan ke hapas penetasan. Sebuah hapa penetasan terdiri dari dua bagian terpisah dari hapa, hapa luar dan hapa dalam. Hapa dalam berukuran lebih kecil dan dipasang di dalam hapa luar. Hapa bagian luar terbuat dari kain tipis dengan ukuran standar 2 x 1 x 1 m sedangkan hapa bagian dalam terbuat dari kain kelambu berbentuk bulat dengan ukuran 1,75 x 0,75 x 0,5 m. Semua sudut hapas luar dan dalam dilengkapi dengan loop dan tali untuk memudahkan pemasangan. Sekitar 75, 000 ke 1, 00, 000 telur tersebar merata di dalam setiap hapa bagian dalam. Telur menetas dalam 14-20 jam pada kisaran suhu 24-310 C. Masa inkubasi, nyatanya, berbanding terbalik dengan suhu. Setelah menetas, tukik melarikan diri ke hapa luar melalui jerat hapa dalam. Hapa bagian dalam berisi cangkang telur dan telur mati yang dikeluarkan saat penetasan selesai. Tukik tetap berada di hapa luar tanpa gangguan sampai hari ketiga setelah menetas. Selama periode ini, mereka hidup dari makanan yang disimpan di kantung kuning telur mereka. Pada hari ketiga mulut sudah terbentuk dan tukik mulai bergerak dan memberi makan. Pada tahap ini mereka dikumpulkan dengan hati-hati dari hapa penetasan luar dan ditebar ke pembibitan yang sudah disiapkan.
Telah ditemukan bahwa ikan mas besar India dapat diinduksi untuk bertelur dua kali pada musim yang sama dengan selang waktu dua bulan. Indukan setelah pemijahan pertama diberi makan bungkil kacang tanah dan dedak dengan perbandingan 1:1 pada 2,5 persen dari bobot badan. Ketika kondisi iklim yang menguntungkan terjadi, mereka dewasa dan siap untuk pemijahan.
Di dalam D uce D Br e edin G w Saya T H H.C. G .
Saat ini ekstraksi kelenjar pituitari adalah teknik yang mapan untuk pemuliaan terinduksi di seluruh dunia. Penggunaan skala besar menimbulkan masalah berikut berkaitan dengan ketersediaan dan kualitas kelenjar pituitari (P.G). Pasokan P.G. yang tidak memadai, harga tinggi, variabilitas potensi gonadotropin hipofisis dan kecurangan oleh P.G. pemasok. Untuk mengatasi masalah-masalah tersebut, Human Chorionic Gonadotropin (H.C.G) telah ditemukan sebagai alternatif untuk kelenjar pituitari. H.C.G. ditemukan pada awal tahun 1927 oleh Aschheim dan Zondek. Mereka mengekstraksi hormon berkualitas baik dengan aktivitas luteinising gonadotrophic dari urin wanita hamil. Pekerja Rusia pertama kali menggunakan chorionic gonadotropin pada tahun 1964 dengan nama dagang sebagai Choriogohin dan mendapatkan hasil yang baik di Loach. Bratanor (1963) dan Gerbilski (1965) menggunakan H.C.G pada ikan mas dan trout dan mencapai kesuksesan besar. Tang (1968) menyatakan bahwa ketika ikan mas Cina diperlakukan dengan pituitari ikan dalam kombinasi dengan C.G., efektivitas pada pemuliaan yang diinduksi meningkat. Sebuah bacaan literatur menunjukkan bahwa H.C.G. efektif baik sendiri atau dalam kombinasi dengan P.G. ekstrak dalam menginduksi berbagai ikan di seluruh dunia.
H.C.G. adalah gliko-protein atau sialo-protein, karena molekul karbohidrat melekat pada molekul protein. Fungsi utamanya adalah mempertahankan produksi estrogen dan progesteron oleh korpus luteum. Ini diproduksi oleh plasenta dan diekskresikan melalui urin selama tahap awal kehamilan (2-4 bulan). H.C.G terdiri dari 2 sub-unit a dan b dan memiliki ukuran molekul 45, 000-50, 000 dalton. Ada 17 asam amino di dalamnya, dari mana alanin, prolin, serin, sistin dan histidin penting. Karena banyaknya asam amino, H.C.G. memiliki kandungan protein yang tinggi. Berat molekul telah dilaporkan sebagai 59, 000 dengan filtrasi gel dan 47, 000 dengan kesetimbangan sedimentasi.
Selama tahap awal kehamilan H.C.G. kaya akan urin ibu hamil. Beberapa metode digunakan untuk ekstraksi H.C.G. Aschheim dan Zondek (1927) menggunakan etanol untuk pengendapan. Katzman dan Caina menggunakan penyerap yang berbeda. Ekstraksi H.C.G mentah komersial dibuat dengan filtrasi gel.
Hormon perangsang folikel (FSH) dan hormon luteinisasi (LH) dari hipofisis memainkan peran penting dalam reproduksi normal ikan yaitu, dalam mempromosikan perkembangan gonad, pertumbuhan, kematangan dan pemijahan. H.C.G kurang lebih memiliki sifat dan fungsi yang mirip dengan F.S.H dan L.H. Karena kelenjar pituitari digunakan untuk pembiakan ikan yang diinduksi, H.C.G juga dapat digunakan untuk pematangan awal gonad. Keunggulan H.C.G atas P.G dapat diukur dengan alasan berikut. Ikan mencapai kematangan lebih cepat dengan H.C.G., pemijahan musim kawin dapat ditingkatkan dengan H.C.G., H.C.G. memastikan kelangsungan hidup bibit yang lebih baik, itu mengurangi kesenjangan waktu antara dosis persiapan dan akhir, H.C.G lebih ekonomis dan memiliki umur simpan yang lama, H.C.G mudah tersedia dari sumber standar, karenanya lebih dapat diandalkan, suntikan H.C.G secara berkala sepanjang tahun memastikan kesehatan yang lebih baik dan peningkatan berat badan dan perkembangan gonad Potensi H.C.G diketahui (30 IU/ mg), tersedia dalam paket rapi dengan bobot yang diketahui, tidak ada pelestarian yang terlibat, tidak boleh palsu, Ikan yang diberi perlakuan H.C.G dapat digunakan lebih dari satu kali untuk pembiakan induksi pada musim yang sama, tingkat kematian tukik diabaikan, konsumsi obat lebih sedikit selama pembiakan yang diinduksi, H.C.G dapat digunakan sebagai hormon pertumbuhan dan penyerapan telur pada akhir musim kawin relatif lebih sedikit dengan pemberian H.C.G.
H.C.G mentah berbentuk bubuk dan berwarna putih keabu-abuan atau kuning muda. Ini mudah larut dalam air. Jumlah H.C.G mentah yang dihitung dimasukkan ke dalam jaringan homogeniser dan diaduk selama 5-10 menit dengan air suling terukur. Disentrifugasi selama 3-5 menit. Cairan supernant bening kekuningan yang mengandung hormon H.C.G diambil dan disuntikkan segera. Setiap penundaan penggunaan akan mengakibatkan hilangnya potensi.
Untuk ikan mas perak (Hypophthalmichthyes molitrix), penggunaan H.C.G ternyata cukup berhasil. Dosisnya 4-6 mg/kg. berat badan pria, dan 6-8 mg/kg berat badan dosis pertama dan setelah sekitar 6-7 jam, 10-12 mg/kg berat badan dosis kedua untuk wanita yang memberikan hasil yang baik. Penggunaan hanya H.C.G dalam pemuliaan ikan mas India belum memberikan hasil yang sukses sejauh ini. Kombinasi 60-80% H.C.G dan 40-20% P.G untuk karper utama India dan karper rumput (Ctenopharyngodon idella) berhasil. Ikan yang diinduksi untuk berkembang biak dengan H.C.G saja adalah belanak, Cyprinus carpio, Lctalurus punctatus, Oreochromis nilotica, arististis nobilis, Misgurnus fosilis, Esox lucius dan Epinephelus tauvina.
Karya terbaru menunjukkan bahwa kombinasi H.C.G dan P.G. lebih direkomendasikan daripada H.C.G atau P.G saja. Lebih banyak pekerjaan perlu dilakukan untuk menstandarisasi dosis H.C.G untuk pemuliaan ikan mas besar dan ikan mas Cina yang diinduksi.
Di dalam D uce D Bree D di dalam G w dia H HAI uap Saya M
Karena masalah berbagai potensi hipofisis, alternatif dicoba. Berbagai upaya telah dilakukan di berbagai negara untuk menggunakan analog hormon luteinisasi – hormon pelepas (LH-RH) untuk pemuliaan ikan yang diinduksi dengan berbagai tingkat keberhasilan. Namun, keberhasilan yang dicapai dengan LH-RH tidak selalu konsisten, terlepas dari persyaratan dosis yang lebih tinggi untuk induksi pemijahan. Penyelidikan pada zaman ini membuka jalan bagi pengembangan teknologi sederhana dan efektif untuk pemuliaan terinduksi sebagian besar ikan yang dapat dibudidayakan. Dalam proyek kolaborasi bersama, didanai oleh Pusat Penelitian Pembangunan Internasional, Kanada kepada Dr. Lin dari China dan Dr. Peter dari Kanada, Serangkaian investigasi dilakukan untuk mengembangkan teknologi yang andal dalam pemuliaan ikan. Penyelidikan mereka mengarah pada pengembangan teknik baru yang disebut metode 'LNPE', dimana analog LH-RH dikombinasikan dengan antagonis dopamin. Berdasarkan prinsip tersebut, Laboratorium Syndel M/s Terbatas, Kanada telah memproduksi obat baru yang disebut ovaprim.
Ovaprim adalah produk siap pakai dan larutannya stabil pada suhu lingkungan. Ini mengandung analog 20 g Salmon gonadotropin releasing hormone (sGnPHa) dan antagonis dopamin, domperidon 10 mg/ml. Potensi ovaprim seragam dan mengandung sGnRHa yang diketahui 17 kali lebih kuat dari LH-RH (Peter, 1987). Antagonis dopamin, domperidone yang digunakan dalam ovaprim juga dilaporkan lebih baik daripada antogonist lain yang umum digunakan, pimozida. Ovaprim menjadi produk siap pakai dan tidak memerlukan penyimpanan berpendingin, tampaknya menjadi agen ovulasi yang paling nyaman dan efektif.
Obat ini diberikan kepada indukan ikan betina dan jantan secara bersamaan dalam dosis tunggal, tidak seperti ekstrak hipofisis yang diberikan dalam dua dosis terpisah. Hal ini tidak hanya mengurangi penanganan induk ikan tetapi juga membantu dalam menghemat banyak waktu dan tenaga yang akan menambah biaya produksi benih. Respon pemijahan pada spesies yang diobati ditemukan lebih unggul daripada spesies yang disuntikkan ekstrak hipofisis.
The efficiency of ovaprim for induced breeding of carps have given highly encouraging results in catla, rohu, mrigal, silver carp, grass carp, big head, etc. The effective dose required for various species of carps is found to vary considerably. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully. Di India, initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
In D uce D br e edin G w Saya T H Hai vati D e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Ind kamu ce D B reedin G wit H Ovop e aku
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish. Namun, preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, in India, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998). Di India, Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
HAI T dia R Su B sta n ce S kita e D F Hai R Saya n duc e D B R ee D di dalam G
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R H analo G ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
S T e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
Cl Hai miph e ne :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E S T Saya M A T Saya Hai n Hai F E G G S :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
B R tidur Saya n G Hai F C Hai M mo n C ar p :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 to 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.







